Czym jest elektrochemia?
Od energii chemicznej do elektrycznej i z powrotem
Elektrochemia zajmuje się głównie dwoma zjawiskami. Po pierwsze, konwersją energii chemicznej w energię elektryczną, która stanowi podstawę akumulatorów i baterii. Ponadto, konwersją energii elektrycznej w energię chemiczną, co można podsumować terminami elektroliza i galwanotechnika. Dzięki tym technikom możliwe jest rozłożenie wodnych roztworów soli na ich atomy, ale także pokrycie kawałka metalu cienką warstwą innego metalu. Szczególnie ten ostatni proces ma wiele zastosowań; część złotej biżuterii tak naprawdę jest wykonana ze srebra, na które naniesiono cienką warstwę złota. Galwanizacja jest również szeroko stosowana w elektronice. Jedną z metod nakładania cyny na warstwy miedziane, obok najbardziej popularnego procesu mechanicznego (HASL), oraz chemicznego (chemical tin plating) jest właśnie galwanizacja (electroplating). W elektrocynowaniu cyna jest nakładana za pomocą prądu elektrycznego. Jony cyny w roztworze reagują z powierzchnią miedziową pod wpływem prądu, co prowadzi do osadzania się warstwy cyny na powierzchni PCB. Procesy galwaniczne wykorzystuje się również podczas metalizacji otworów w płytkach dwu i wielowarstwowych (płytka PCB stanowi katodę i umieszczana jest w elektrolicie, który zawiera sole miedzi, po czym na skutek przepływu prądu elektrycznego na ściankach otworów jak również na całej jej powierzchni osadza się (dodatkowa) warstwa miedzi). Złącza krawędziowe płytek drukowanych są w ten sam sposób pokrywane cienką warstwą złota. To samo dzieje się ze stykami lepszych typów przekaźników i przełączników (i różnych złączy – przyp. tłum.). Krótko mówiąc, elektrochemia ma wiele nieoczekiwanych zastosowań.
Historia rozwoju elektrochemii
Elektryczność i chemia
Od XVIII wieku wiadomo było, że elektryczność i chemia mają ze sobą wiele wspólnego. Przy okazji doświadczeń z elektrycznością statyczną zaobserwowano, iż elektryczność jest w stanie powodować kurczenie się mięśni. Fakt ten był używany jako uzasadnienie używania elektryczności statycznej w celach terapeutycznych w latach 50. XVIII wieku. Rażenie prądem z maszyny elektrostatycznej miało leczyć kurcze mięśni i paraliż.
Luigi Galvani
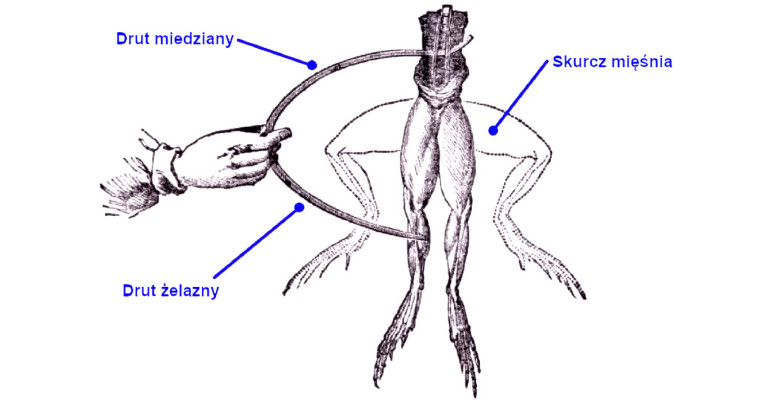
Włoski fizjolog i anatom, Luigi Galvani zajmował się badaniami nad działaniem i rolą nerwów. Eksperymentując z ciałami martwych żab zaobserwował on, iż mięśnie kurczą się pod wpływem prądu. Pozwoliło mu to zbudować prosty, choć czuły instrument wykrywający elektryczność – galwanoskop żabi. W przyrządzie tym mięsień z nogi świeżo zabitej żaby miał przyłączone przewody na obu końcach. Gdy przyłączyło się te przewody do źródła elektryczności, mięsień się kurczył, co potwierdzało jej obecność. Przy okazji tego odkrycia Galvani zaobserwował też, iż mięsień żaby może się kurczyć bez obecności zewnętrznego źródła elektryczności. Rysunek poniżej pokazuje jego słynny eksperyment z nogami żaby, w którym do końców mięśni podłączone były druty wykonane z różnych metali. Po połączeniu ze sobą wolnych końców, mięśnie się kurczą.
Galvani słusznie wywnioskował z tego, że elektryczność jest w jakiś sposób obecna w zamkniętym układzie miedzi, żelaza i mięśni. Galvani jednak wyciągnął z tego błędny wniosek, według którego w zwierzętach istnieje do tej pory nieznana siła witalna, którą nazwał „elektrycznością zwierzęcą”, która nie jest tożsama z „naturalną” elektrycznością (pioruny) czy „sztuczną” elektrycznością wytwarzaną przez człowieka z pomocą maszyn elektrostatycznych. Według jego teorii mózg wytwarza „elektryczny fluid”, który nerwami trafia do mięśni, powodując ich skurcze. Ponadto tkanki według Galvaniego zachowują się analogicznie do butelek lejdejskich (prymitywnych kondensatorów) i gromadzą ten „elektryczny fluid”. Teoria ta była generalnie przyjęta przez środowisko naukowe, z jednym wyjątkiem.
Alessandro Volta
Rodak Galvaniego, Alessandro Volta nie uznawał tego wyjaśnienia. Według niego mięsień był niczym więcej niż instrumentem używanym do określenia obecności elektryczności. Elektryczność była wynikiem kontaktu dwóch różnych metali. W końcu, gdyby eksperyment Galvaniego został przeprowadzony z dwoma przewodami wykonanymi z tego samego metalu, nic by się nie stało. Volta zaczął pracować nad swoją wizją eksperymentalnie i wkrótce odkrył, że do wytworzenia elektryczności nie jest potrzebny żaden materiał zwierzęcy. Jeśli umieścić dwa przewodniki wykonane z różnych metali w roztworze przewodzącym, między dwoma przewodnikami pojawiła się różnica napięcia. W ten sposób Volta był w stanie stworzyć pierwszą prymitywną baterię, która nosi nazwę „ogniwo Volty”, znaną również jako „stos Volty”.
Ogniwo Volty
Ogniwo Volty składało się ze szklanego naczynia wypełnionego rozcieńczonym roztworem kwasu siarkowego. W naczyniu tym zawieszono miedzianą i cynkową płytkę. Volta był w stanie wykazać, że między dwiema płytkami wytworzyło się napięcie około 1,1 V. W innym eksperymencie Volta stworzył swój stos, który składał się z wielu dysków ułożonych naprzemiennie: dysk miedziany, dysk z tektury nasączonej solanką lub innym elektrolitem, dysk cynkowy, i ponownie dysk miedziany, tekturowy i cynkowy, i tak dalej. Stos ten nie tylko zapewniał dużo wyższe napięcie, niż pojedyncze ogniwo, ale też prąd elektryczny w ilości wystarczającej do prowadzenia innych eksperymentów. Stanowiło to poważny problem dla ówczesnych naukowców. Koncepcja „elektronu” była wciąż nieznana, ale wiadomo było, że prąd elektryczny musi składać się z „czegoś”. To „coś” musiało więc również przepływać przez przewodzący roztwór stosu Volty. Minie wiele czasu, zanim zjawisko to zostanie naukowo wyjaśnione.